Електронната конфигурацията на атомите
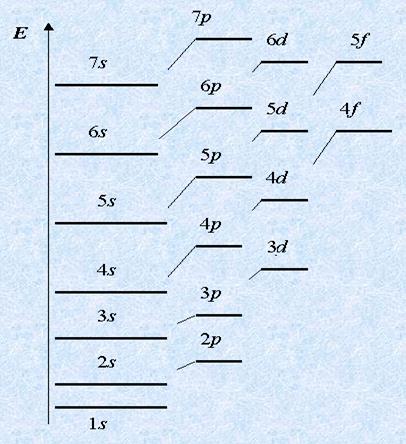
Електроните в ядрото не са подредени на случаен принцип, и слоеве - енергийни нива. Тези нива са етажи в сградата - първи, втори, трети и така нататък.
И дори в рамките на всяко ниво са електронни поднива - а, р, D, F, които са разположени съответно атомна орбитала S, Р, D, F-тип.
Най-голям е броят "етаж" - ниво, "горе" (по-нататък от ядрото) са електрони това ниво.
На първото ниво може да бъде един S-подниво,
Второто за две поднива: а и р.
- трети "три поднива (а, р и г), на четвърти - четири (а, р, D, F).
Електронни поднива, както и енергия и подове - нива варират в сила.
Те са разположени на различна енергия "висока".
Учените са съгласни, за да се обозначи всеки атомен орбитален
квантовата клетка - квадрат на енергия диаграма:
На -podurovne и може да бъде една атомна орбитална и р -podurovne може да има три (по трите координатни оси):
Орбитали на D - и е -podurovnya в атом, могат да имат съответно пет и седем:
Всеки електрон, ще бъдат обозначени със стрелка, сочеща нагоре или надолу, и в същото време само се съгласявате, че в полето за квантова могат да бъдат поставени най-много два електрона с стрелки, сочещи в различни посоки, така:
напълно населен с електрони
Всички електронни нива и поднива, който току-що представяни като диаграми, се характеризират с определена енергия.
И най-важното, за всички електроните в един атом, тази "определена енергия" е с отрицателна стойност (по-малко от 0), и това е още по-негативни, отколкото орбиталната по-близо до ядрото.
Първият е изпълнен с най-печелившата първото ниво на енергия, и едва след това втори, трети и така нататък. Освен това, в рамките на същото ниво е първият изпълнен с подслой чиято енергия е по-ниска. Например, първите две електроните падат на 2s-подслой, а след това - 2p подниво; Първите 3 мастни киселини, а след това 3p подниво.
Но след това започва объркването: след 4s е попълнено 4P и 3D-подниво. Но това е само на пръв поглед. Всъщност, всичко е в съответствие с правилата, тъй като енергията на 3D-подниво по-ниска от 4P. Ето защо, той се занимава с електрони и преди.
Преместването в атомна орбитала на електрони. Обикновено най-малко енергия, на принципа на Паули изключване и правило Hund е
Уреждане на атомни орбитали с електрони правило определя минимална енергия принцип Паули и правило Hund му.
Електроните заемат атомни орбитали, тъй като подслой с по-ниска енергия. Това обикновено е най-малко енергия. Последователността в енергийния натрупването Какви са поднива: 1s <2s <2p <3s <3p <4s ≤ 3d <4p <5s и так далее …
Според изчисленията, електронът не се движи по отношение на един път, и може да бъде във всяка част на перинуклеотиден пространство - т.е. може да се говори само за вероятността (възможност) на своето местоположение на известно разстояние от ядрото.
Електроните в атоми заемат енергично благоприятни атомна орбитала (орбитали на ниска енергия) за образуване на електрони облаци определена форма.
В случая на S-орбиталния електронен облак е сферична:
В случая на р-орбитали образуват гира с електронен облак :.
Вътре атомните орбитите на вероятността за намиране на електрона е голям; С други думи, има голяма електронна плътност. Пространството извън обхвата на орбитите съответства на ниска електронна плътност.
Във всяка атомна орбитала може да се постави максимум два електрона (принцип Pauli).
В присъствието на орбитите на същата енергия (например, три р орбитите един подниво) всеки орбитален е изпълнен първата половина (и следователно на р-под-слой не може да бъде повече от три несдвоени електрони) и след това напълно да образуват електронни двойки (правило Hund е) ,
Броят на възможните поднива равен брой ниво. Първото ниво се състои от един-единствен
S-подниво. Вторият слой се състои от два подслоя - а и р. Трето ниво - три поднива - S, Р и г.
Всеки подслой може да бъде строго ограничен от броя на електроните:
на S-подниво - вече не 2д;
на р-подниво - вече не 6e;
на г-подниво - не повече от 10 секунди.
едно ниво на поднива се пълнят в строг ред: с р г.
По този начин, р-поднива не могат да започнат да се запълни, ако е попълнено S-подслой на нивото на енергия и т.н.
Енергийният диаграма на електронен слой на атома на водорода и хелий:
водороден атом може да загуби своята един електрон, който също е външен и валентността, и се превръща в водороден катион:
Н с 0 - 1 e- = Н +
Това означава, че водородът се окислява - участва в процеса на окисление. Но един водороден атом може да бъде възстановен и - да приеме електрон. Процесът на възстановяване ще водород анион, който се нарича също хидрид анион:
Н 0 1 + e- = Н -
Въглеродният атом, се превърна в състояние не само да се откажат от своите електрони - окислени, но и да се предприемат - да се възстанови:
С 0 - 4, e- = С + IV
C 0 + 4 e- = C -IV
Real катиони и аниони на въглероден съществуват следователно в горните уравнения реакциите тук писмени знаци въглеродни атома в окисление + IV и -IV.
степента на окисление - това кондиционирани заряд, който може да бъде атомите на различни елементи в химически съединения.
Някои модели в Периодичната таблица D. Менделеев.
В периодичната таблица организира не само елементи, но също и голямо разнообразие от имоти. Химик е достатъчно често, за да имаме пред очите ми на периодичната таблица, с цел да се отговори правилно на много въпроси (а не само на изпита, но и научно).
Нека да погледнем отново в периодичната таблица. В допълнение към дълбоката фундаментална връзка между елементите, тя отразява редица полезни за изучаване на законите на химията. Помислете за най-важните от тях (фиг.).
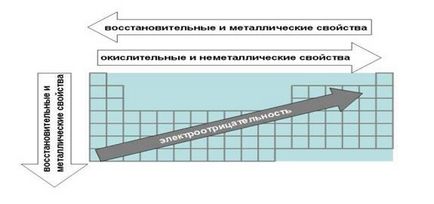
Фиг. Закони на Периодичната таблица, свързани с електроотрицателните метални и редокс свойства елементи.
а) закони, свързани с метални и неметални свойства на елементите.
1. Когато се движи от дясно на ляво по свойства метален страни за периода подобрени. В обратна посока увеличава неметални.
Това се дължи на факта, че правилата са елементите, които електронен слой по-близо до октет. Елементи в дясната част на период по-малко вероятно да се откажат от електрони, за да се образува метален връзка, и като цяло в химични реакции.
Например, въглерод - неметални по-изразено от своя съсед в период бор и азот има по-ярки неметални свойства от въглерод.
От ляво на дясно в период също се е увеличил, както и заряда на ядрото. Следователно, увеличаването на привличането на основните и валентни електрони възпрепятствано тяхното откат.

в) закони, свързани с размерите на атомите.
6. Размери атома (атомен радиус), когато се движат отляво надясно по намалява период. Това се дължи на факта, че електроните са все по-привлечени от ядрото с увеличаването на ядрени заряда. Дори и увеличаване на броя на електроните в външната обвивка (например флуор в сравнение с кислород) не води до увеличаване на размера на атом. Напротив, размерите на флуорен атом е по-малко от кислороден атом, (фиг. 4).
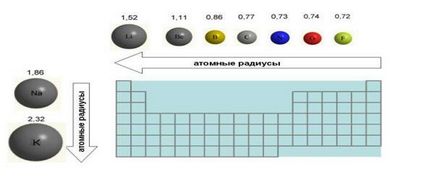
Фиг. Промяна на атомната радиусите на примерни елементи на второ период и първа група на Периодичната таблица. Атомна радиуси дадени в ангстрьома (1 А = 10 -8 cm).
7. Когато се движи отгоре надолу атомни радиуси елементи растат, тъй като той е изпълнен с повече електронни обвивки.
Periodicheskiyzakon Менделеев: свойства на химичните елементи, както и свойства на прости и сложни съединения, образувани от тях са в периодично зареждане в зависимост от ядрата на атомите.
Физическата смисъла на периодичната закона свойства на химичните елементи са периодично повтарящи защото повтаря периодично конфигурация валентните електрони (разпределение на електрони и предпоследния външни нива).