Как да напишете електронна конфигурация на всеки елемент на атома
Намерете своя атомен номер на атома. Всеки атом има определен брой електрони, свързани с него. Намерете вашия характер атом в периодичната таблица. Атомен номер - е положително цяло число, започвайки от 1 (водород) и нараства с по едно във всеки следващ атом. Атомен номер - е броят на протона в атома, и следователно, е също така броя на електроните в атома с нула заплащане.
Определя такса атом. Неутралните атоми ще имат същия брой електрони, както е показано в Периодичната таблица. Въпреки това, заредени атоми ще имат по-голям или по-малък брой електрони - в зависимост от мащаба на тяхното заплащане. Ако използвате със заредена атом, да добавяте или изваждате електрони, както следва: добавете един електрон за всеки отрицателен заряд и се изважда по един за всяка положителна.
- Например, натриев атом със заряд от -1 ще има допълнително електрони в допълнение към основната си атомен номер 11. С други думи, сумата от атом ще бъде 12 електрони.
- S-подниво (произволен брой електронен конфигурация, която стои в предната част на буквата "а") съдържа един орбитален, и според принципа на Паули. един орбитален може да съдържа максимум 2 електрони, следователно, всеки S-подниво електрон черупка 2 може да бъде един електрон.
- р-подслой включва три орбитален, и следователно може да съдържа максимум 6 електрони.
- г-орбитали подслой съдържа 5, така че може да има до 10 електрони.
- F-орбитали подслой съдържа 7, така че може да има до 14 електрони.
- Например, най-простият електрон конфигурация: 1s 2 2s 2 2p 6. Тази конфигурация показва, че има два 1s подниво електрони, две електрони - 2s подслой и шест електрони в подниво 2Т. 2 + 2 + 6 = 10 електрони общо. Това - електронен конфигурацията на неутрален атом Ne (атомен номер неон -10).
- Електронни атомна конфигурация, в която изпълни цялата орбитала ще има следната форма: 1s 2 2s 2 2p 6 3s 2 3P 6 4s 2 3d 10 4P 6 5s 2 4d 10 5р 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7P 6
- Имайте предвид, че по-горе протокол, когато всички попълнено орбитален електронен конфигурация е UUO елемент (Унуноктий) 118, атоми на периодичната система с най-голям брой. Ето защо, тази електронна конфигурация съдържа всички познати в нашето време електронни поднива неутрално заредени атом.
- Напълнете орбитите по реда даден по-горе, докато стигнете до двадесети електрона. Първият е 1S орбитали два електронни орбитали за 2s - и двата на 2p - шест за 3s - две на 3P - 6, и 4s - 2 (2 + 2 + 6 +2 +6 + 2 = 20 ). с други думи, електронна конфигурация калциев има формата: 1s 2s 2 2 2 2p 6 3s 3P 6 4s 2.
- Забележка: орбитали са подредени в реда на нарастване на енергия. Например, когато сте готови да отидете на ниво четвърти енергия, трябва първо да запише 4s орбитална, след 3г. След четвъртото ниво на енергия да преминете към петата, която се повтаря същата процедура. Това се случва само след трето ниво на енергия.
Използвайте периодичната таблица като визуални ориентири. Вероятно сте забелязали, че формата на периодичната система съответства на реда на електронни поднива в електронните конфигурации. Например, атомите в секунда лявата колона винаги завършват на "и 2", и атомите на десния край на средната част на тънък край в "D 10" и т.н. Използвайте периодичната система като визуален наръчник за писане конфигурации - например в реда, в който можете да добавите към орбитите отговаря на вашата позиция в таблицата. Вижте по-долу:
- По-специално, двете левите колони съдържат атоми, чиито електронен конфигурации завършва S-орбитали в таблицата на полето блок представени атома, чиито край конфигурация р-орбитали, и в долния край атоми, F-орбити.
- Така например, когато пишете електронна конфигурация хлор, мисля, както следва: "Този атом се намира в третия ред (или" тече ") от периодичната таблица и той се намира в петата група на орбиталния модул р на периодичната система Затова неговата електронна конфигурация ще завърши в ... 3p 5
- Забележка - елементите на г и е орбитален таблицата характеризира с нивата на енергия, които не съответстват на периода, в който те се намират. Например, първият ред на блоковите елементи с г-орбитали съответства 3d орбитали, въпреки че се намира в четири период, и първият ред от елементи съответства на F-орбитали орбитален 4f, въпреки факта, че тя е 6-период.
- За да се разбере това понятие, е полезно да се напише например конфигурация. Нека напиши конфигурацията на цинк (атомен номер 30), като се използва намаляване съдържащ благороден газ. Пълен цинк конфигурация изглежда така: 1s 2 2s 2 2p 6 3s 2 3P 6 4s 2 3d 10. Въпреки това, ние виждаме, че 1S 2 2s 2 2p 6 3s 2 3P 6 - електронен конфигурация на аргон, благороден газ. Просто замени част от електронния конфигурацията на аргон химически символ запис цинк в квадратните скоби ([Аг]).
- Така електронен конфигурация цинк записва в съкратен вид, има формата: [Аг] 4s 2 10 3d.


Как да се намери броя на протони, неутрони и електрони
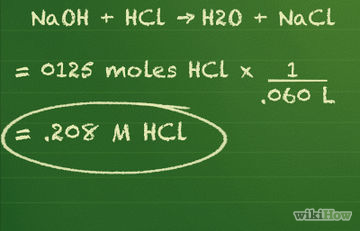

Как да се изчисли концентрацията на разтвора


Как да използвате периодичната таблица

Как да си направим сух лед


Как да съхранявате сух лед

Как да подкиселява почвата


Как да се мине изпита по химия


Как да се изчисли моларност на разтвора
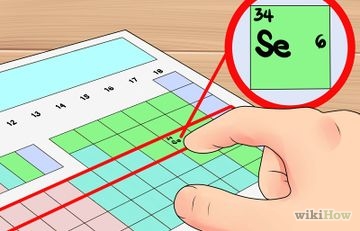

Как да определите валентните електрони