електронна конфигурация
Електронната конфигурация на елемента е разпределението на електроните в неговите атоми запис на черупки, subshells и орбити. Електронната конфигурация обикновено е написана за атоми в земята им състояние. Електронен атомната конфигурация, в която един или повече електрони в възбудено състояние се нарича развълнуван конфигурация. За да се определи специфичната конфигурация на електронния елемент в основното състояние, следните три правила: Правило 1: попълване принцип. Съгласно принципа на пълнене, електроните в основното състояние на атомна орбитална се пълни в увеличение последователност орбитални нива на енергия. По-ниски енергийни орбитали са винаги първи пълни.
водород; атомен номер = 1; брой на електрони = 1
Това един електрон в водороден атом трябва да заемат S-орбитални на К-участъка от около поради всички възможни орбитите тя има ниска енергия (вж. Фиг. 1.21). Electron на този S-орбитална се нарича LS-електрон. Водородът в основно състояние има електронна конфигурация Is1.
Правило 2: Принцип на Паули. Съгласно този принцип, по всяко орбитална може да бъде не повече от два електрона и то само ако те имат противоположни завъртания (върти неравни числа).
литий; Атомен номер = 3; брой на електрони = 3
Orbital с най-ниска енергия е 1-ци-орбитална на. Това може да отнеме само на два електрони. Тези електрони трябва да бъде неравно назад. Ако означен въртенето +1/2 стрелка нагоре и се върти -1/2 стрелка сочи надолу, двата електрони с противоположния (антипаралелен) завъртания в същата орбитала може да бъде представена схематично на запис (фиг. 1.27)
В един орбитален не може да бъде два електрона със същата (паралел) завъртания:
Третият електрона в един атом на литиев да заемат орбитална енергия от следващата ниската орбитален, т.е. 2в-орбиталния. Така, литиев е електронно конфигуриран Is22s1.
Правило 3: Hund правило. Съгласно това правило, пълненето започва орбитали един subshell електрони с паралелна единична (знак за равенство) завъртания и само след единични електрони заемат всички орбитали могат да възникнат крайните пълнене орбитали двойки електрони с противоположни завъртания.
азот; атомен номер = 7; брой на електрони = 7 азот има електронен конфигурация ls22s22p3. Три електрони в 2P subshell, трябва да се поставят един по един на всеки от трите 2p орбитите. В същото време, всички три на електрона трябва да има паралелни завъртания (фиг. 1.22).
Таблица. 1.6 показва Електронната конфигурация на елементи с атомни номера на от 1 до 20.
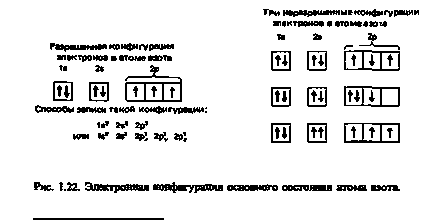
Таблица 1.6. Електронната конфигурация на основното състояние на елементи с атомен номер от 1 до 20
